水産由来成分のなかには優れた健康機能性を有するものが多く存在します。それらの成分を機能性食品の開発に応用することは大変重要な事だと考えられます。私のグループでは健康機能性のうち生活習慣病の予防、改善に注目して、血中の中性脂肪やコレステロールの低下作用や、脂肪肝改善や肝機能改善作用を有する成分(魚油中のドコサヘキサエン酸(DHA), エイコサペンタエン酸(EPA), タウリン、セレノネイン)について生活習慣病モデルマウス等を用いて、その効果や作用機序について研究しています。生まれつき生活習慣病になっているモデルマウスに水産由来成分やそれを含む食品を3〜4週間摂取させ、病態の改善が認められるか解析し、その場合の作用機序についても明らかにしています。さらに機能性成分を含む食品を摂取した際の機能性成分の体の中への吸収のされ方、臓器への蓄積についての研究も実施し、機能性食品の開発につながる研究を実施しています。以下にその内容を紹介いたします。
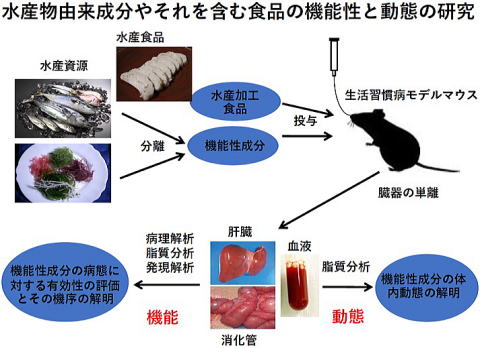
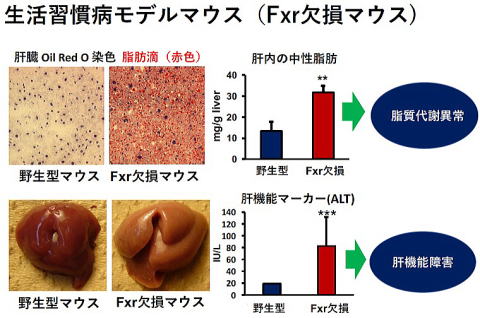
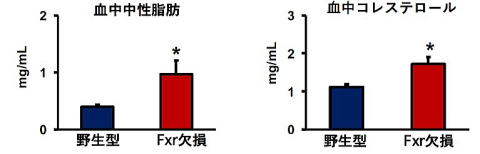
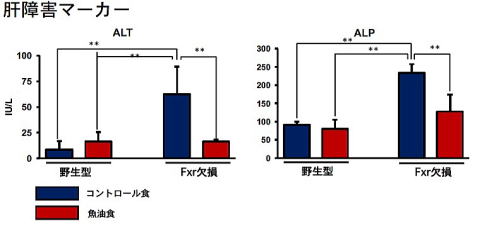
生活習慣病モデルマウスを用いて研究しています。このマウスは胆汁酸の受容体であるfarnesoid X receptor (FXR)の遺伝子を欠損しているマウス(Fxr欠損マウス)で、Fxrのノックアウトマウスと呼ばれ、生まれつき生活習慣病を発症しています1)。米国に留学中に作製し、現在水産大学校の動物飼育施設で繁殖しています。その特徴として肝臓が変色し肥大しており、中性脂肪が肝臓に蓄積して脂肪肝になっています。肝障害のマーカーが上昇しており肝機能障害が認められます1, 2)。血中の中性脂肪(トリグリセリド)やコレステロールレベルも上昇しており脂質代謝異常が認められます。長期に飼育すると肝がんを発症することなどから脂肪性肝疾患のモデルとも考えられています。脂質代謝異常、肝機能障害、あるいは肝がんの予防や改善について評価できるマウスです。
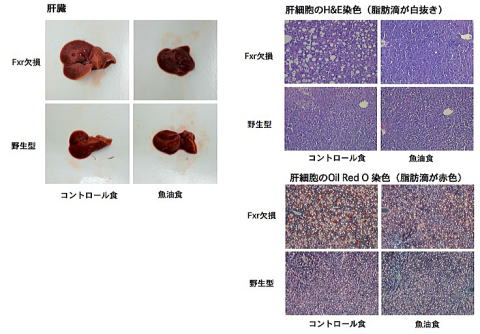
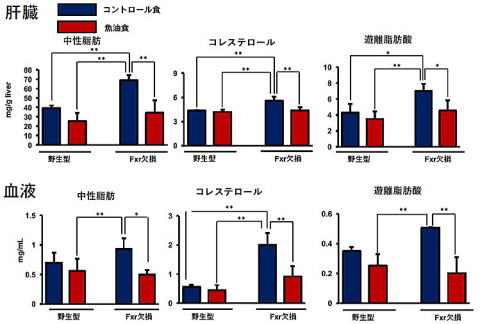
魚油は脂質代謝改善作用や脳機能の活性化など多くの機能性を持ち機能性食品への応用が盛んになされています。これらの魚油の持つ機能が様々な疾患の予防に効果があると考えられていますが、生活習慣病を発症している状態からの改善効果があるのかについては十分に明らかにされていません。また生活習慣病モデルマウス(Fxr欠損マウス)の機能性評価系としての有用性を担保するため、生活習慣病を発症している雌性Fxr欠損マウスと野生型マウスを用いて魚油の生活習慣病に対する改善効果について検討しました。本マウスに4%コーン油食 (コントロール食)と2%魚油+2%コーン油食(魚油食)を4週間摂取させて解析しました。
Fxr欠損マウスの魚油群では肝臓の肥大が解消し、肝臓の色調も野生型マウスのレベルまで改善されました。また肝臓に蓄積した脂肪滴が野生型マウスレベルまで減少しました。
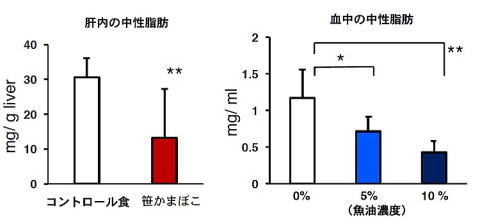
魚油を添加した飼料で健康機能性が評価できたことから、次に魚油を含んだ食品の健康機能性を生活習慣病モデルマウスで解析しました。有限会社マルヨ鈴木商店との共同研究で5%あるいは10%魚油添加笹かまぼこと無添加笹かまぼこの健康機能性を評価しました。各々の笹かまぼこを凍結乾燥し50%の割合で精製飼料(AIN-93M)に添加しました。コントロール食として笹かまぼこと同一の栄養組成をカゼイン、コーンスターチ、大豆油、食塩で調製し、50%の割合で精製飼料(AIN-93M)に添加しました。これらの食餌を雄性Fxr欠損マウスに21日間摂取させて、肝臓と血液中の中性脂肪のレベルを測定しました。笹かまぼこ群でコントロール群に比べ肝内の中性脂肪のレベルが有意に低下しました。一方笹かまぼこに魚油を添加することで、濃度依存的に血液中の中性脂肪が低下しました。添加された魚油による血中の中性脂肪低下作用に加え、笹かまぼこ成分自体にも肝臓の中性脂肪低下作用がある可能性が示されました。またFxr欠損マウスは機能性食品の脂質改善作用の評価にも有用であることが示されました。
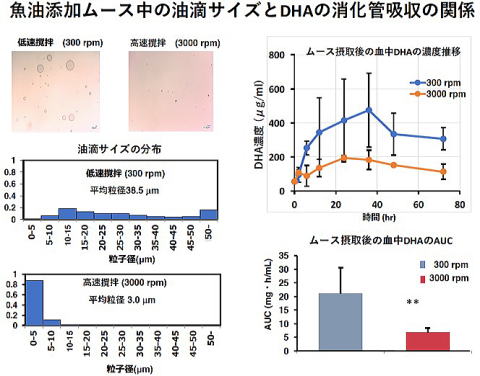
魚油は様々な機能性を有するため食品への添加が盛んになされています。一般に魚油が生体内で機能性を発揮するには、消化管から十分吸収され体内に蓄積することが不可欠です。ところがどのような形態で魚油を食品に添加すれば消化管からの魚油中の機能性成分であるドコサヘキサエン酸(DHA)の吸収が良好となるかについてはほとんど知見がありません。そこでマルハニチロ株式会社と共同研究でムース中に添加される魚油の添加方法(添加時の攪拌数)を変えることで魚油の油滴サイズを変化させたムースを作製し、消化管からのDHAの吸収性の変動についてマウスを用い解析しました。油滴サイズの異なるムースをマウスに強制経口投与した後、マウスの血液を経時的に採取して血液中のDHA濃度を測定し、消化管吸収の指標となる血中濃度曲線下面積(AUC)を求めました。その結果魚油を低速で攪拌することにより添加し作製した、魚油の平均油滴サイズの大きいムースを投与したマウスの血中のDHA濃度は高く、AUCは大きくなりました。このことより魚油の添加は低速攪拌で行い、魚油の平均油滴サイズをある範囲内で大きくすることが、消化管からのDHAの吸収を増加させることが示唆されました。よって魚油を食品に添加する方法を検討することで魚油中の機能性成分(DHA)の吸収の良い食品の開発ができることが示唆されました。これらの内容を特許出願しています。
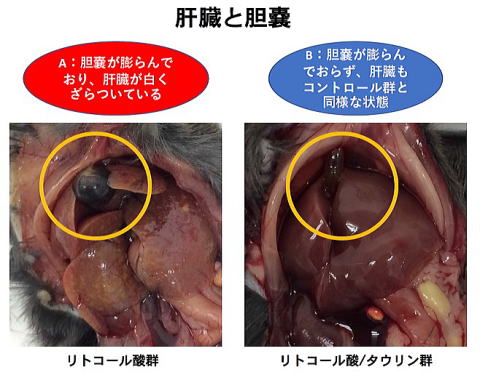
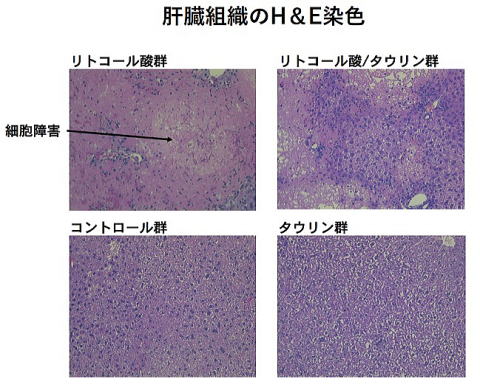
いかやたこなどの魚介類に多く含まれるアミノ酸類縁体であるタウリンは肝機能の改善作用や脂質低下作用等の多くの機能性が報告されており、タウリンを含んだ飲料などが販売されています。ところが、タウリンによる肝機能改善作用の機序については不明な点が多く存在します。本研究では肝臓に細胞障害や胆汁鬱滞を誘起し、肝毒性を有するリトコール酸(LCA)をマウスに摂取させて肝障害モデルを作製しました。同時にタウリンを摂取させることで、肝障害が軽減されるか解析しました。C57BL/6雄性マウスに0%あるいは0.8%LCA添加食を摂取させ、コントロール群あるいはリトコール酸群として水道水をタウリン群あるいはリトコール酸/タウリン群として2%タウリン添加水道水を10日間摂取させて解析しました。リトコール酸群の肝臓は白く変色し、障害が顕著にみとめられ、胆嚢に胆汁が蓄積していました。一方リトコール酸/タウリン群では肝臓はコントロール群と同様な状態であり、胆嚢への胆汁の蓄積も少量しか認められませんでした。肝細胞のH&E染色においてもリトコール酸群で顕著な細胞障害が認められましたが、リトコール酸/タウリン群ではこれらの障害が軽減していました。
参考文献